Un principe fondamental de la neurochirurgie moderne est la surveillance continue des fonctions cérébrales pendant les interventions chirurgicales. Cela est rendu possible grâce au neuromonitoring peropératoire (IONM), également appelé neurophysiologie peropératoire ou surveillance neurophysiologique peropératoire. Grâce à des techniques neurophysiologiques avancées, les fonctions du système nerveux sont surveillées et protégées en temps réel. L'objectif principal est de minimiser les dommages neurologiques lors des interventions, en particulier lorsqu'elles sont réalisées à proximité de structures neurologiques sensibles, et ainsi de garantir au maximum la sécurité et le bien-être des patients.
Le neuromonitoring peropératoire (IONM) est une priorité de notre clinique. Nous faisons partie des établissements de pointe à l’échelle internationale dans ce domaine, notamment en ce qui concerne l’équipement technologique, les méthodes peropératoires, l’expérience, le nombre de patients traités et les publications scientifiques. Notre clinique a joué et continue de jouer un rôle clé dans le développement de nouvelles techniques à l’échelle mondiale pour prévenir les déficits neurologiques.
Pourquoi un neuromonitoring peropératoire ?
Deux concepts sont suivis pendant chaque opération :
- atteindre l'objectif de l'opération, par exemple l'ablation radicale de la tumeur.
- éviter que l'opérationne provoque des déficits neurologiques qui réduisent la qualité de vie du patient *, *.
C'est pourquoi toute opération doit être guidée par la fonction *, *, *, *, *, *. L'accent est mis sur les points suivants :
Prévention des lésions nerveuses
L'IONM permet de détecter précocement les modifications de la fonction nerveuse qui pourraient indiquer une lésion imminente.
Aide à la prise de décision chirurgicale
Pendant l'intervention, l'IONM fournit des informations en temps réel qui aident le chirurgien à accéder, à naviguer et à réaliser l'opération.
Amélioration de la sécurité des patients
Le risque de déficits neurologiques postopératoires peut être considérablement réduit grâce aux techniques d'IONM, car le chirurgien peut réagir immédiatement aux lésions potentielles.
Monitoring
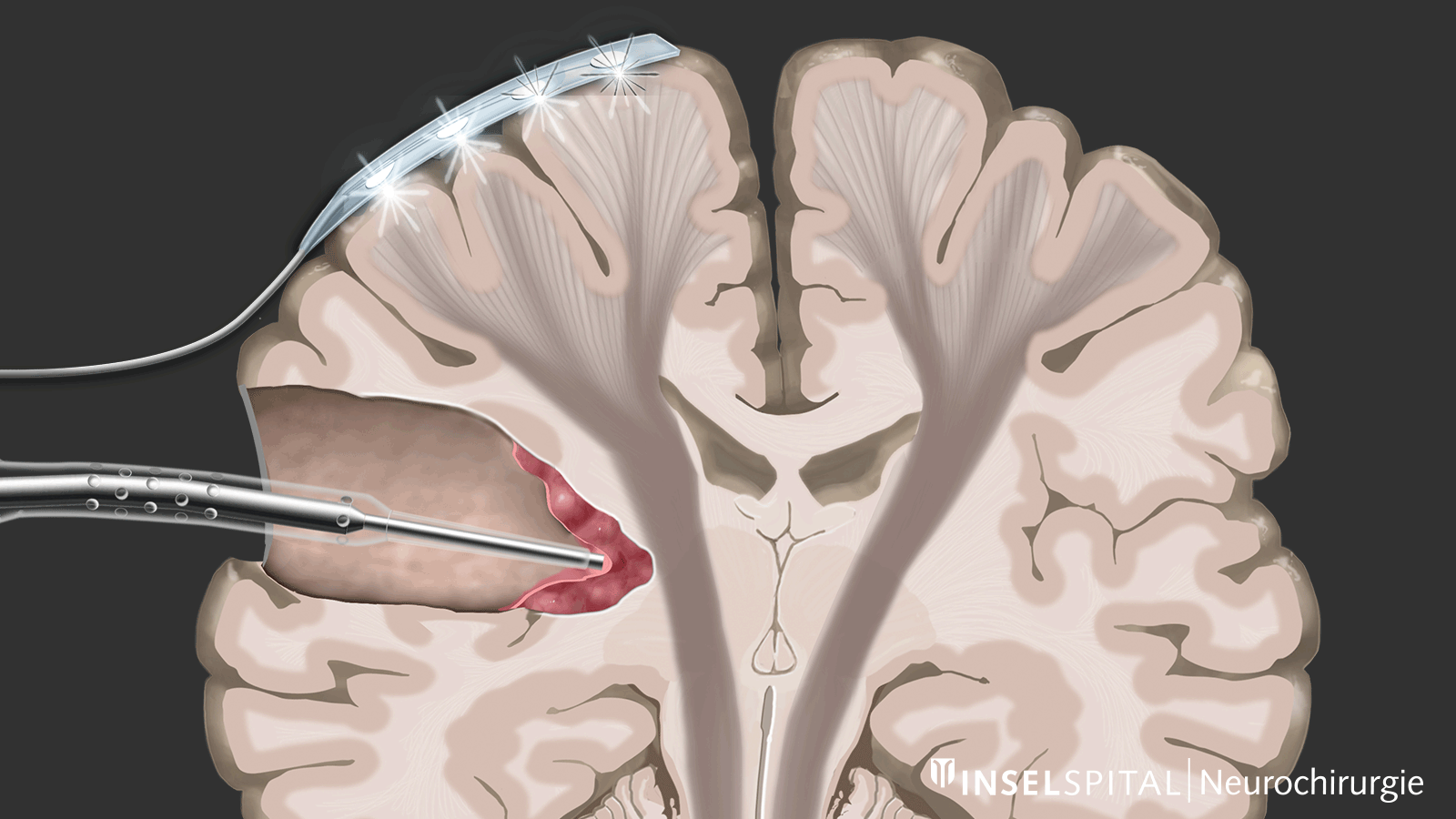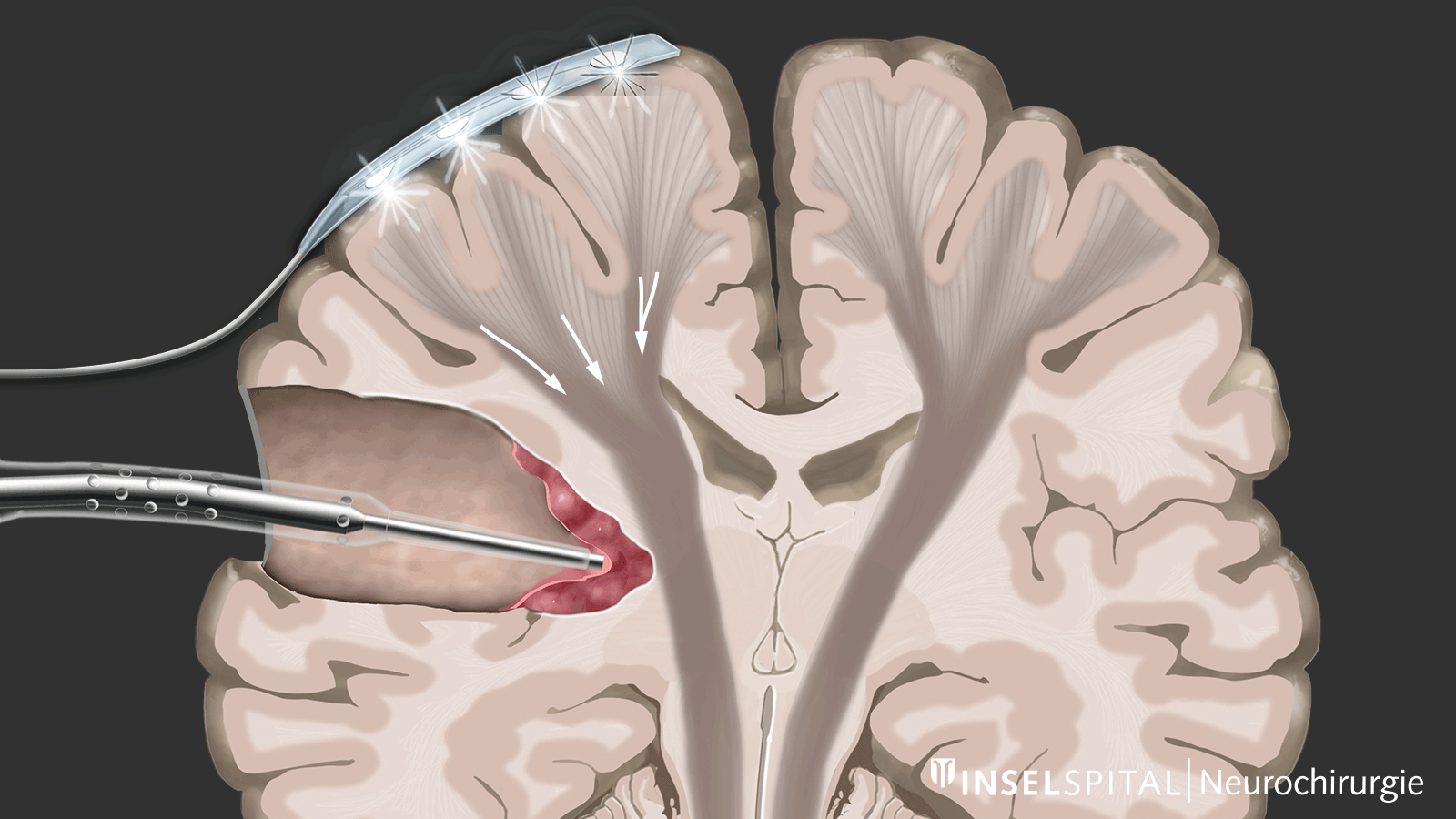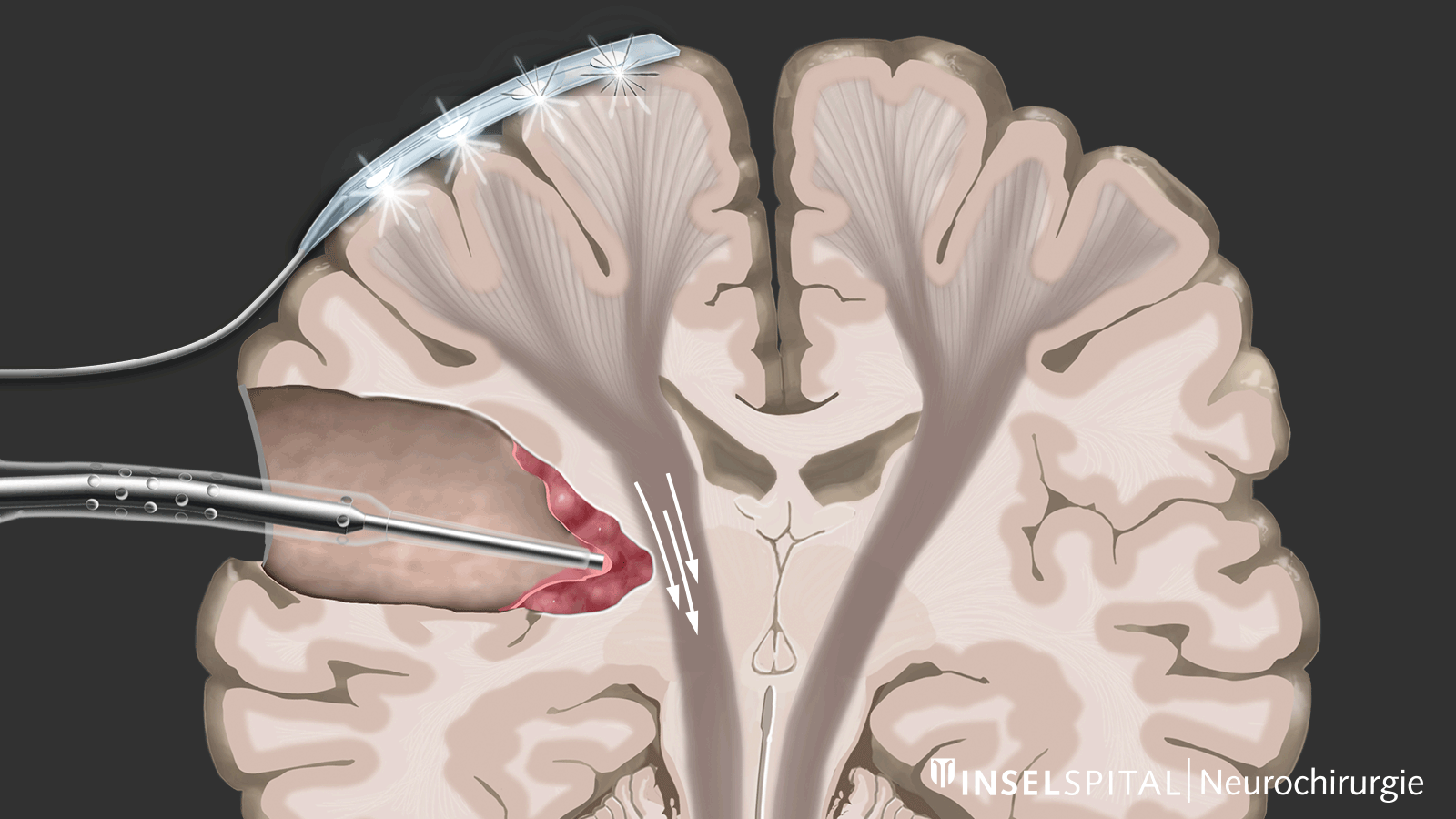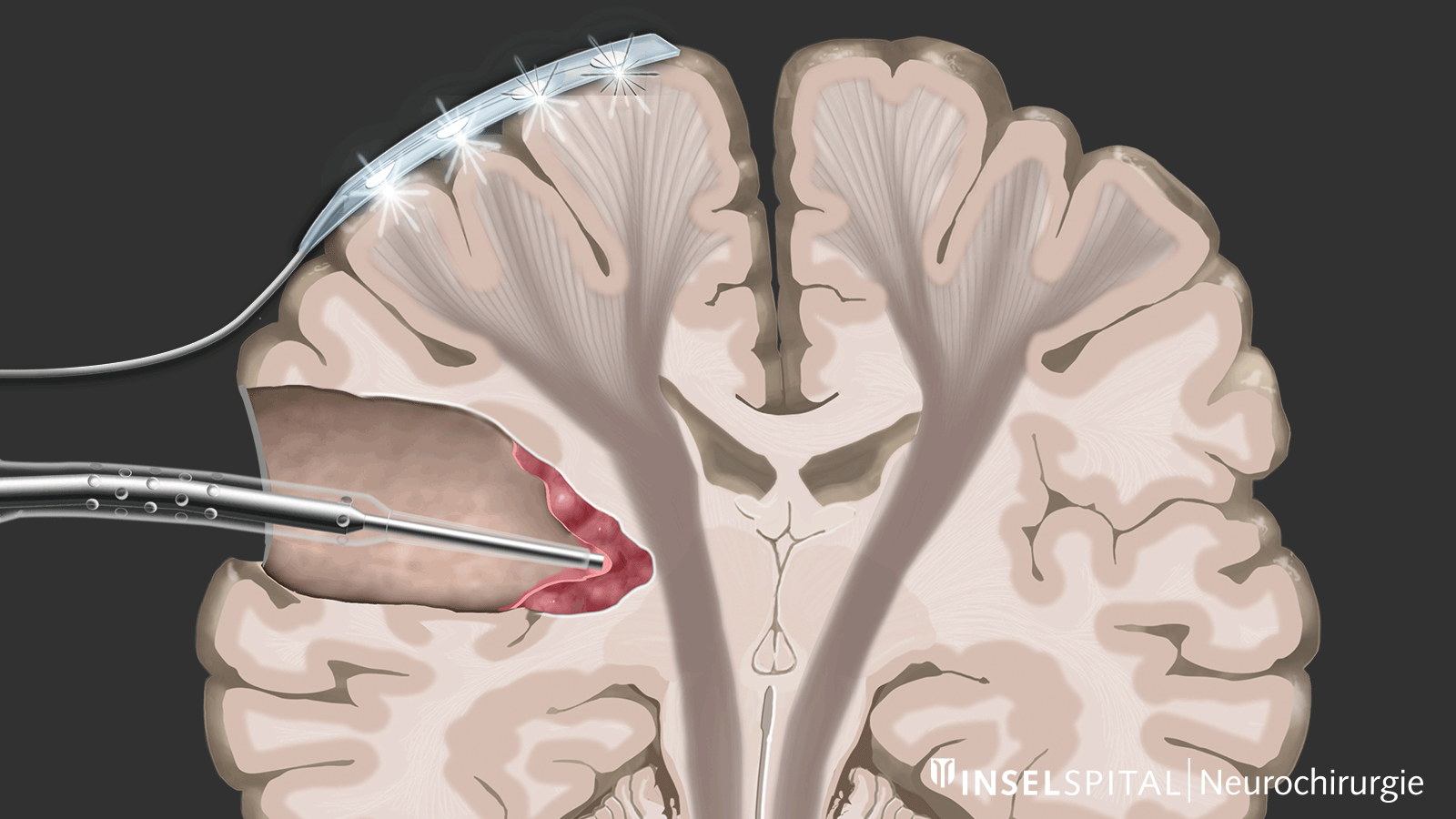
Parmi les techniques de neuromonitoring peropératoire, on trouve des méthodes qui stimulent de manière constante une zone fonctionnelle connue du tissu cérébral et nerveux pendant l'opération, permettant ainsi de surveiller cette fonction. Cela est appelé monitoring.
Mapping
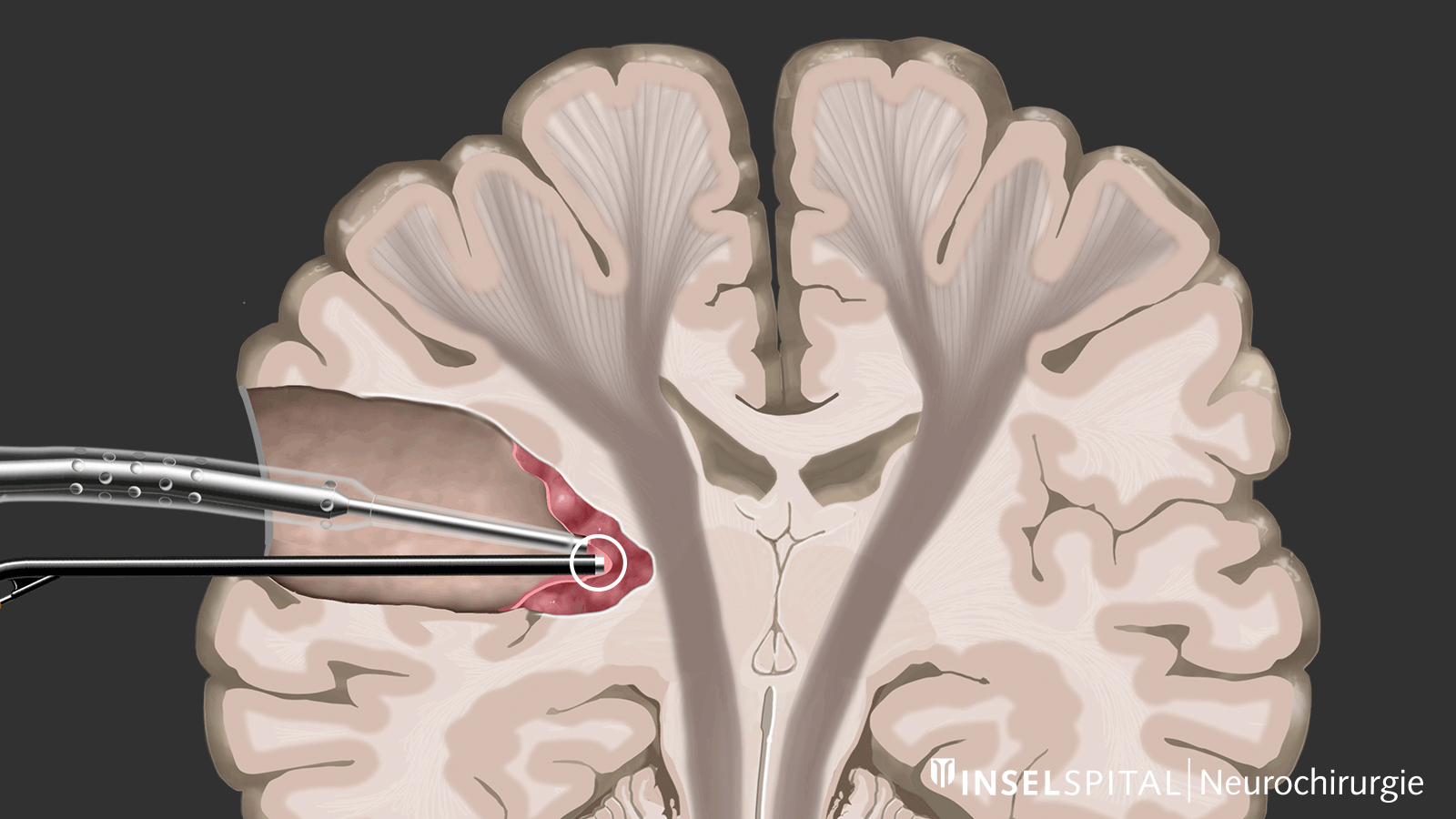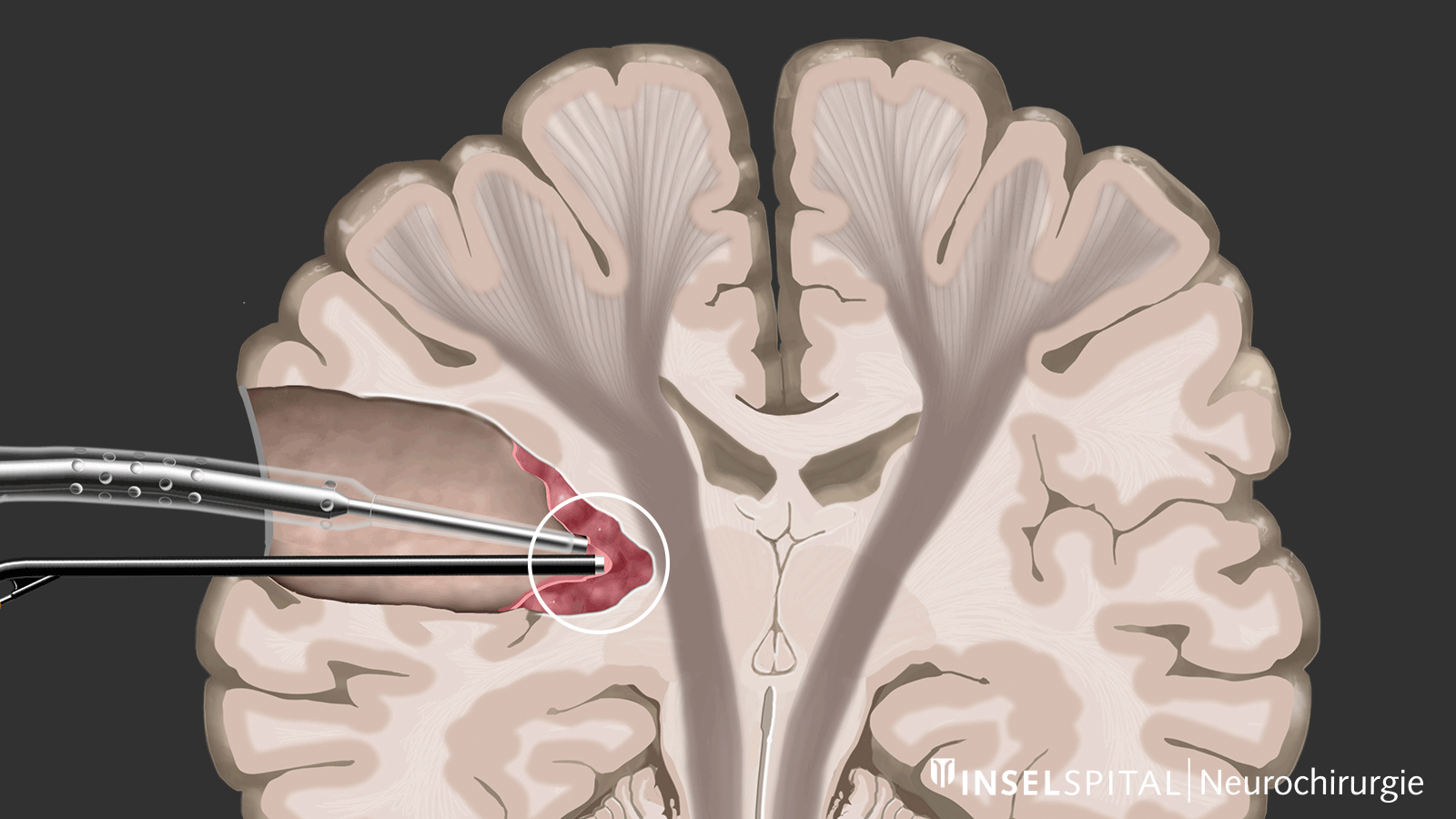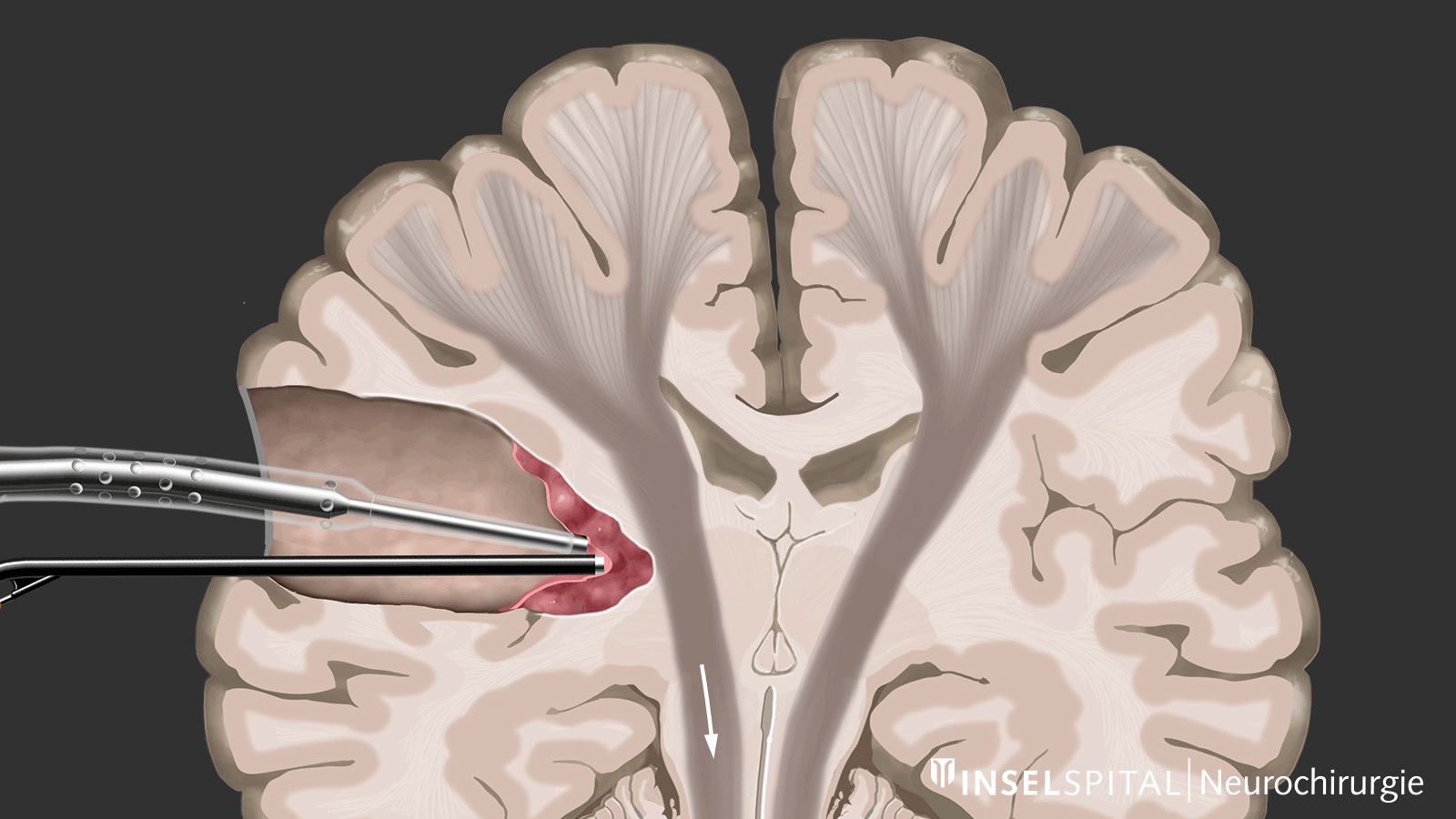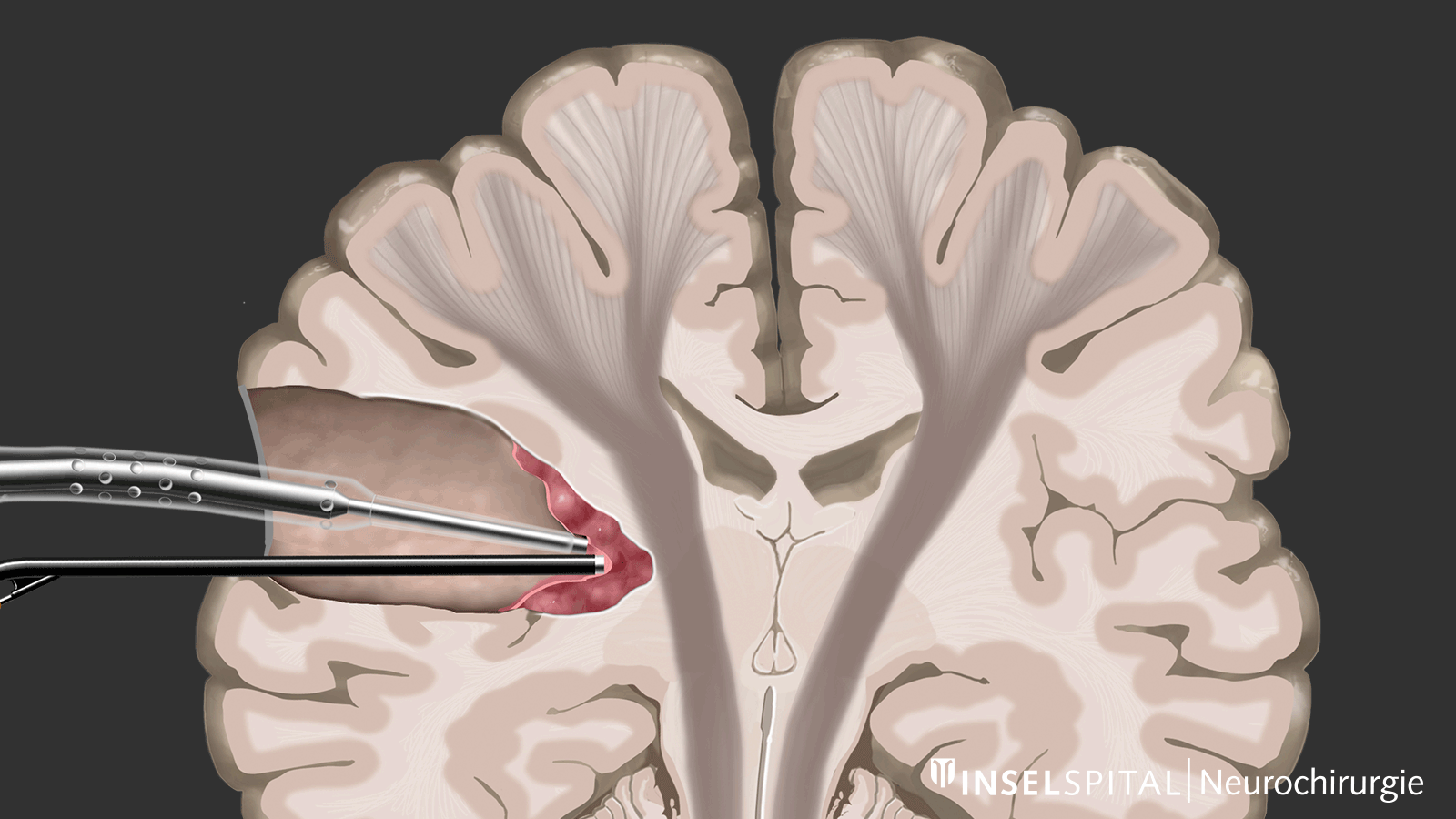
D'autre part, il existe des méthodes qui permettent de détecter des tissus fonctionnels encore inconnus à proximité de la zone opératoire, un peu comme un « radar de recherche », et d'alerter à temps avant leur localisation, ce que l'on appelle le mapping.
Opération éveillée
L'opération éveillée fait également partie du neuromonitoring peropératoire (IONM), car elle permet de surveiller en temps réel la fonction des zones cérébrales critiques en maintenant le patient éveillé et réactif pendant l'intervention. Cela aide à préserver des fonctions importantes telles que la parole et le mouvement, en cartographiant directement les régions cérébrales correspondantes et en évitant ainsi des lésions.
Tumeurs cérébrales
Une résection complète ou presque complète (en anglais gross total resection ou GTR) reste le gold standard pour la plupart des opérations de tumeurs intracrâniennes. Il existe des preuves à ce sujet pour les glioblastomes, les astrocytomes, les oligodendrogliomes et d'autres gliomes *, *, *, *, *, *, *.
La possibilité d'opérer une tumeur cérébrale dépend en premier lieu de sa localisation et de sa proximité avec des fonctions cérébrales critiques. Sur la base des images IRM, 10 à 20 % des tumeurs cérébrales sont considérées à tort comme « éloquentes » et inopérables *, *, *. Seuls le mapping et le monitoring peropératoires montrent en réalité si une tumeur jugée inopérable au préalable l'est vraiment *. Grâce à des méthodes de mapping spécials, une telle tumeur peut néanmoins être opérée en toute sécurité dans la majorité des cas.
Anévrismes cérébraux
Lors du clippage d'anévrismes, il est essentiel que la grosse artère reste ouverte, tandis que le sac anévrismal est complètement clippé - c'est-à-dire fermé. De nombreuses études ont montré que cette opération n'est pas parfaite dans environ 10 % des cas. Dans ce cas, le neuromonitoring peropératoire permet de détecter immédiatement les perturbations de la circulation sanguine lorsqu'elles sont critiques. Nous utilisons le monitorage de la fonction motrice et de la perception sensorielle pour presque toutes les opérations d'anévrisme. Les deux sont effectués sous anesthésie.
Tumeurs de la moelle épinière
Dans ce type d'opération, ce sont surtout les voies motrices qui sont menacées. La plupart du temps, la tumeur se trouve à proximité immédiate d'une ou des deux voies, dont la lésion peut entraîner une paraplégie. Les opérations de la moelle épinière doivent toujours être effectuées avec un monitoring sophistiqué des potentiels évoqués moteurs (PEM), des potentiels évoqués sensitifs (PES), des ondes D et, le cas échéant, avec une cartographie des cordons postérieurs et de la voie pyramidale.
Schwannomes vestibulaires
Dans les schwannomes vestibulaires, la fonction auditive et la fonction du nerf facial, le nerf facial, sont particulièrement importantes. Le nerf facial est souvent fusionné avec la capsule tumorale. Lors d'une opération, sept techniques de surveillance différentes sont utilisées simultanément.
Tumeurs du tronc cérébral
Le tronc cérébral abrite les noyaux des nerfs crâniens et toutes les voies qui relient le cerveau à la moelle épinière. Avec la moelle épinière, c'est la zone qui concentre le plus de fonctions importantes. Une opération dans cette zone nécessite un neuromonitoring peropératoire sophistiqué avec jusqu'à 8 techniques différentes en même temps.
-
Chang EF, Clark A, Smith JS, et al. Functional mapping-guided resection of low-grade gliomas in eloquent areas of the brain: improvement of long-term survival. Clinical article. Journal of neurosurgery 2011;114(3):566-73.
-
De Witt Hamer PC, Robles SG, Zwinderman AH, et al. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. Journal of clinical oncology. 2012;30(20):2559-65.
-
Raabe A, Beck J, Schucht P, et al. Continuous dynamic mapping of the corticospinal tract during surgery of motor eloquent brain tumors: evaluation of a new method. Journal of neurosurgery 2014;120(5):1015-24.
-
Bello L, Riva M, Fava E, et al. Tailoring neurophysiological strategies with clinical context enhances resection and safety and expands indications in gliomas involving motor pathways. Neuro-oncology 2014;16(8):1110-28.
-
Sala F, Lanteri P. Brain surgery in motor areas: the invaluable assistance of intraoperative neurophysiological monitoring. Journal of neurosurgical sciences 2003;47(2):79-88.
-
Seidel K, Beck J, Stieglitz L, et al. The warning-sign hierarchy between quantitative subcortical motor mapping and continuous motor evoked potential monitoring during resection of supratentorial brain tumors. Journal of neurosurgery 2013;118(2):287-96.
-
Smith JS, Chang EF, Lamborn KR, et al. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. Journal of clinical oncology. 2008;26(8):1338-45.
-
Stummer W, Reulen HJ, Meinel T, et al. Extent of resection and survival in glioblastoma multiforme: identification of and adjustment for bias. Neurosurgery 2008;62(3):564-76; discussion 64-76.
-
Senft C, Bink A, Franz K, et al. Intraoperative MRI guidance and extent of resection in glioma surgery: a randomised, controlled trial. Lancet Oncol;12(11):997-1003.
-
Sanai N, Snyder LA, Honea NJ, et al. Intraoperative confocal microscopy in the visualization of 5-aminolevulinic acid fluorescence in low-grade gliomas. J Neurosurg;115(4):740-8.
-
McGirt MJ, Chaichana KL, Gathinji M, et al. Independent association of extent of resection with survival in patients with malignant brain astrocytoma. Journal of neurosurgery 2009;110(1):156-62.
-
McGirt MJ, Chaichana KL, Attenello FJ, et al. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery 2008;63(4):700-7; author reply 07-8.
-
Lacroix M, Abi-Said D, Fourney DR, et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival. Journal of neurosurgery 2001;95(2):190-8.
-
De Witt Hamer PC, Robles SG, Zwinderman AH, et al. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. J Clin Oncol;30(20):2559-65.
-
Stummer W, Pichlmeier U, Meinel T, et al. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. The lancet oncology 2006;7(5):392-401.
Littérature complémentaire
Livres/Chapitre de livre
- Deletis V, Shils J, Sala F, Seidel K. Neurophysiology in Neurosurgery. A modern intraoperative approach. Second edition. Elsevier 2019.
- Deletis V., Seidel K. Intraoperative Neurophysiology during Surgery for Spinal Cord Tumors. In: Arnautović K.I., Gokaslan Z.L. (eds) Spinal Cord Tumors. Springer, Cham. 2019.
Article
- Seidel K, Beck J, Stieglitz L, Schucht P, Raabe A. Low-threshold monopolar motor mapping for resection of primary motor cortex tumors. Neurosurgery. 2012 Sep;71(1 Suppl Operative):104-14; discussion 114-5.
- Seidel K, Beck J, Stieglitz L, Schucht P, Raabe A. The warning-sign hierarchy between quantitative subcortical motor mapping and continuous motor evoked potential monitoring during resection of supratentorial brain Tumors. J Neurosurg. 2013 Feb;118(2):287-96.
- Raabe A, Beck J, Schucht P, Seidel K. Continuous dynamic mapping of the corticospinal tract during surgery of motor eloquent brain tumors: evaluation of a new method. J Neurosurg. 2014 May;120(5):1015-24.
- Schucht P, Seidel K, Beck J, Murek M, Jilch A, Wiest R, Fung C, Raabe A. Intraoperative monopolar mapping during 5-ALA-guided resections of glioblastomas adjacent to motor eloquent areas: evaluation of resection rates and neurological outcome. Neurosurg Focus. 2014 Dec;37(6):E16.
- Raabe A, Seidel K. Prevention of ischemic complications during aneurysm surgery. J Neurosurg Sci. 2016 Mar;60(1):95-103.
- Spena G, Schucht P, Seidel K, Rutten GJ, Freyschlag CF, D'Agata F, Costi E, Zappa F, Fontanella M, Fontaine D, Almairac F, Cavallo M, De Bonis P, Conesa G, Foroglou N, Gil-Robles S, Mandonnet E, Martino J, Picht T, Viegas C, Wager M, Pallud J. Brain tumors in eloquent areas: A European multicenter survey of intraoperative mapping techniques, intraoperative seizures occurrence, and antiepileptic drug prophylaxis. Neurosurg Rev. 2017 Apr;40(2):287-298.
- Krieg SM, Lioumis P, Mäkelä JP, Wilenius J, Karhu J, Hannula H, Savolainen P, Lucas CW, Seidel K, Laakso A, Islam M, Vaalto S, Lehtinen H, Vitikainen AM, Tarapore PE, Picht T. Protocol for motor and language mapping by navigated TMS in patients and healthy volunteers; workshop Report. Acta Neurochir (Wien). 2017 Jul;159(7):1187-1195.
- Tinkhauser G, Pogosyan A, Debove I, Nowacki A, Shah SA, Seidel K, Tan H, Brittain JS, Petermann K, di Biase L, Oertel M, Pollo C, Brown P, Schuepbach M. Directional local field potentials: A tool to optimize deep brain stimulation. Mov Disord. 2018 Jan;33(1):159-164.
- Deletis V, Seidel K, Sala F, Raabe A, Chudy D, Beck J, Kothbauer KF. Intraoperative identification of the corticospinal tract and dorsal column of the spinal cord by electrical Stimulation. J Neurol Neurosurg Psychiatry. 2018 Feb 7. pii: jnnp-2017-317172.
- Seidel K, Biner MS, Zubak I, Rychen J, Beck J, Raabe A. Continuous dynamic mapping to avoid accidental injury of the facial nerve during surgery for large vestibular schwannomas. Neurosurg Rev. 2018 Oct 26.
- Seidel K, Häni L, Lutz K, Zbinden C, Redmann A, Consuegra A, Raabe A, Schucht P. Postoperative navigated transcranial magnetic stimulation to predict motor recovery after surgery of tumors in motor eloquent areas. Clin Neurophysiol. 2019 Jun;130(6):952-959.
